在3D打印的聚己内酯支架中嵌入定向微纳纤维结构以引导细胞浸润和组织再生
-
摘要:
研究论文 ● 开放获取阅读更多
1. 文章导读
3D打印如熔丝制造、激光粉末床熔融制备的可降解组织工程支架为各类组织器官的个性化与活性化修复提供了创新途径,展现出巨大的临床应用潜力。然而,3D打印精度普遍较低,制备支架的特征尺寸在数百微米以上,远大于细胞的特征尺寸(~20 μm),不利于细胞的黏附生长并成长为致密的活性组织。将3D打印与其他工艺复合,能够实现可降解支架多尺度结构的制备,对于提高3D打印支架与细胞的相互作用具有重要意义。近期,西安交通大学机械制造系统工程国家重点实验室的贺健康教授、李涤尘教授、孟子捷博士生和空军军医大学张聚良教授、凌瑞教授、穆星豆博士生在SCI期刊《极端制造》(International Journal of Extreme Manufacturing, IJEM)上共同发表《在3D打印的聚己内酯支架中嵌入定向微纳纤维结构以引导细胞浸润和组织再生》的研究论文,提出复合3D打印、静电纺丝和单向冷冻铸造技术制造具有承重框架和定向微纳纤维结构的复合支架,以期为在现有3D打印支架中增加引导组织再生的额外微纳结构,提高3D打印支架引导宿主组织生长与整合能力提供新思路。
亮点:
● 复合3D打印、静电纺丝和定向冷冻铸造技术制备了具有力学稳定框架和定向纳米纤维结构的复合支架。● 复合支架可以提供体积稳定的环境,引导细胞定向浸润,同时支持脂肪来源干细胞(ADSC)在体外的成脂成熟。● 在植入大鼠皮下后,复合支架引导了宿主组织的定向浸润,促进了周围血管的形成。● 本研究提供了一种在3D打印的支架内产生额外结构引导促进软组织再生的新方法。2. 研究背景
可降解组织工程支架为细胞的黏附、增殖和分化提供必要的结构支撑和有利的生长环境,为实现人体组织或器官的修复与再生提供了可能的解决方案。3D打印技术的出现(如熔丝制造和选区激光烧结技术)使具有定制化结构和机械性能的多孔支架的快速成型成为可能,在各类组织修复和未来临床应用中展现出了巨大潜力。然而,现有的3D打印支架通常具有数百微米的特征尺寸,过大的特征尺寸导致细胞-支架交互弱、细胞黏附差、难以促进组织再生。
近年来,通过结合多种工艺制备的具有多尺度结构的复合支架引起了研究学者的兴趣。多尺度结构可有效提高组织工程支架的细胞接种效率、细胞增殖率以及形态发生、特异性蛋白表达。最近的研究表明,具有定向多孔结构的支架更有利于营养物质和废物的交换,该特性有望促进细胞的浸润和迁移。在本文中,孟子捷等人提出结合3D打印、静电纺丝和单向冷冻铸造与冷冻干燥技术,制备具有力学支撑框架和定向微纳纤维结构的复合支架,并探索了复合支架引导细胞和组织浸润的有效性(图1)。
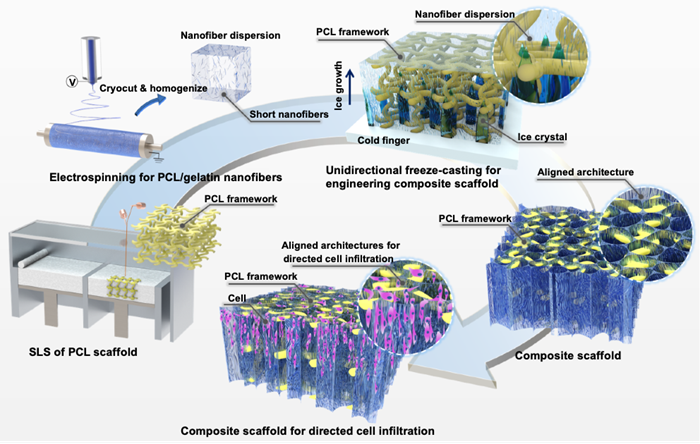
图1 复合3D打印、静电纺丝以及单向冷冻铸造技术制备具有3D打印框架和定向微纳纤维结构复合支架的制造流程示意图。
3. 最新进展
来自西安交通大学的研究人员选用选区激光烧结技术制备了聚己内酯(PCL)大孔支架。采用生物相容性良好的明胶和PCL混合进行静电纺丝,制备了微纳纤维膜,进而利用冷冻切片与超声分散制备了PCL/明胶的短纳米纤维悬液。利用定向冷冻铸造技术,通过调节温度梯度控制定向微纳纤维结构的孔径和方向,在3D打印的PCL大孔支架内部成功构建了定向的微纳纤维结构。从复合支架的电镜图上可以观察到定向微纳纤维结构已经完全包裹住打印的PCL支架(图2a)。压缩试验结果表明,复合微纳纤维结构的复合支架与3D打印的PCL支架力学性能相似,远大于微纳纤维结构的力学性能,因此,复合支架中3D打印的框架有望提供足够的刚度来抵抗体内潜在的力学环境,保持支架的宏观形态不变。

图2 复合支架的结构和力学性能。(a)复合支架水平(i)和垂直(ii,iii)截面的扫描电镜图像。(b)定向微纳纤维结构、PCL支架和复合支架的应力-应变曲线、(c)压缩模量。
为了评估复合支架中定向微纳纤维结构的孔径对细胞附着、增殖和定向浸润的影响,研究者利用骨架染色表征了细胞在复合支架上的浸润迁移情况。与打印的PCL支架相比,复合支架初始阶段就表现出了良好的细胞接种效率(图3a)。培养3-5天,复合支架上也观察到了更好的细胞增殖和迁移(图3b-d)。
具有较小孔洞的复合支架表面被细胞大量附着(图3b),培养3到5天后,其顶面完全被细胞覆盖,形成了均匀且相对致密的细胞层,阻碍了细胞向支架内进一步渗透和进行营养交换(图3b)。对于孔径较大的复合支架,细胞可以沿微孔的边缘生长分布,进而向复合支架深处继续浸润。
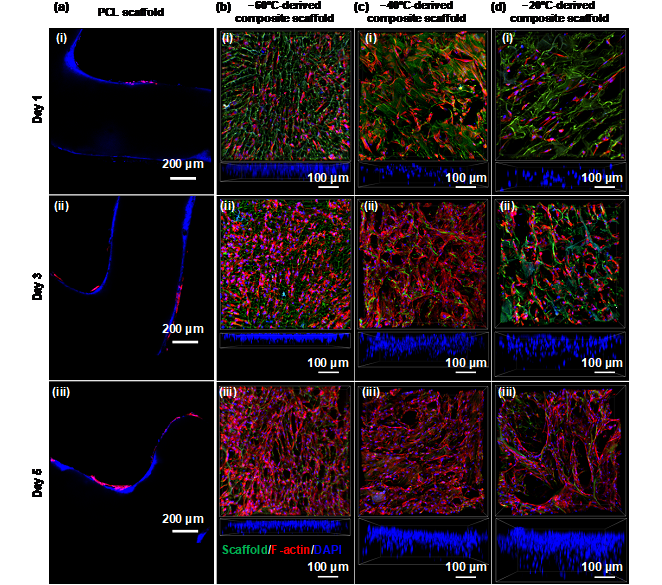
图3 打印的PCL支架和复合支架中细胞生长和分布情况。(a)5天的培养期间,在PCL支架的表面上仅观察到少量细胞黏附,(b-d)而大量细胞可生长并浸润到复合支架的内部。
为了评价复合支架的体内的生物相容性和组织反应,研究人员将具有较大孔径的复合支架植入大鼠皮下。H&E染色发现,4周标本周围有明显的炎性细胞聚集和浸润(图4b,c),在第12周有所减少(图4e,f)。此外,可以看到纤维组织沿着定向的微纳纤维结构有序长入多孔支架内部,植入12周后纤维组织的浸润深度和面积明显增强。血管化对组织的存活至关重要,通过对新生血管数量进行统计,发现复合支架中微纳纤维结构的存在显著增强了新生的微血管密度。
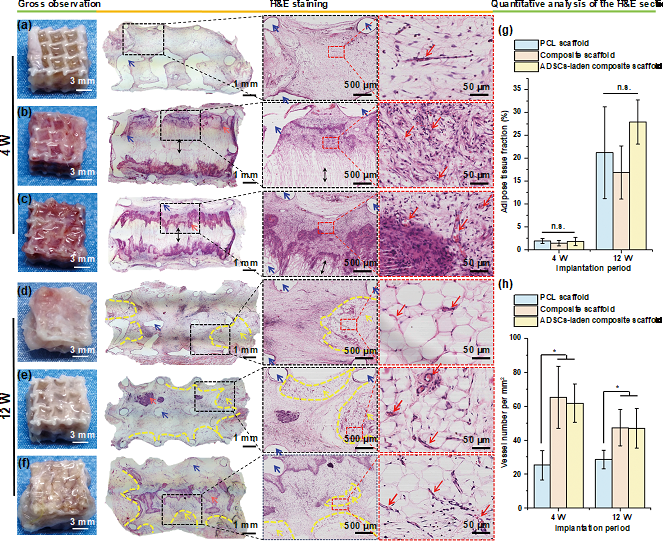
图4 植入物的组织学分析。(a, d) 打印的PCL支架,(b, e) 复合支架,(c, f) 负载ADSCs的复合支架植入4周和12周大体观察与H&E染色图像。(双箭头:支架内微纳纤维结构的定向方向,蓝色箭头:PCL骨架,橙色箭头:肉芽组织,黄色箭头和黄色虚线:脂肪组织,红色箭头:血管) (g, h) 植入支架内脂肪组织的比例和新生血管密度。
4. 未来展望
本文利用3D打印、静电纺丝和单向冷冻铸造技术,制备了具有力学支撑框架和定向微纳纤维结构的复合支架。复合支架中3D打印的PCL框架提供了结构支撑,以维持再生组织的有效体积。定向排列的微纳纤维结构为细胞提供粘附位点,显示出良好的细胞相容性,并允许细胞沿着开放的通道迁移。动物实验结果表明,与单纯3D打印的PCL支架相比,3D复合支架的定向微纳结构可引导宿主组织的浸润,并增强组织血管化。本研究结果可为具备多尺度结构的组织工程支架制造提供新见解,有望用于引导组织的空间有序再生。


 下载:
下载:

