单细胞分辨率生物制造策略综述
-
摘要:
综述 ● 开放获取阅读更多
1. 文章导读
自然界中生物功能的多样化与其复杂的异质结构和成分高度相关。作为一门跨学科生物技术,生物制造将活细胞引入制造过程,使得体外构建复杂生物组织及生命系统成为可能。常用的生物制造方法是对生物材料进行一体式(bulk)成型制造,但是该方法较难实现微观细节和组分的可控分布。基于模块化组装的生物制造方法基于离散-组装的制造思想,使用细胞、生物材料及其结合体作为构建单元来组装所需的图案或结构,能够实现复杂的异质结构制造。近年来随着技术的发展,实现具有单细胞分辨率特征的组织结构的制造已成为可能,大大提高了体外生理/病理组织模型构建的精度和仿生性。近期,清华大学机械工程系的欧阳礼亮团队在《极端制造》期刊(International Journal of Extreme Manufacturing, IJEM)上发表《单细胞分辨率生物制造策略》的综述,系统介绍具有单细胞分辨率的生物制造策略的研究背景、最新进展及未来展望。第一作者为博士生周德志,其他作者包括研究生窦博瀚、Florian Kroh和王楚芊。图1展示了按构建单元维度分类的具有单细胞特征的生物制造技术,其中包括分别对应“点、线、面”三种维度的0D单细胞液滴/微球、1D单细胞纤维和2D单细胞片。
亮点:
● 全面综述了具有不同维度单细胞特征的生物制造方法及其最新进展;
● 强调了单细胞分辨率的生物制造作为基于细胞群生物制造的补充策略的优势;
● 讨论了跨尺度构建单元的模块化组装策略在大尺寸、单细胞特征的高阶复杂异质结构制造的挑战和应用前景。
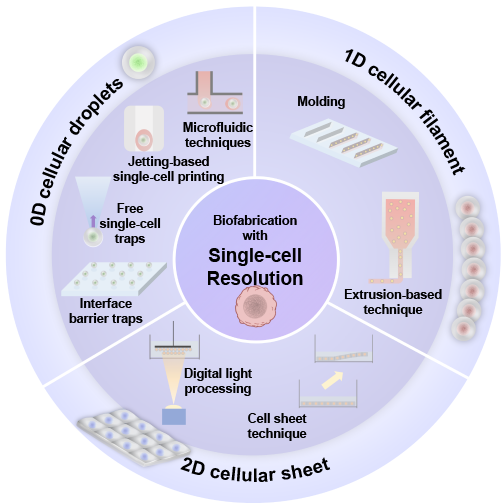
图1 单细胞分辨率构建单元的分类及其代表性生物制造技术。
2. 研究背景
通过在细胞尺度上观察人体组织/器官结构,可以发现这些结构表现出具有低至单细胞水平的精细特征结构(图2)。例如,胰岛由至少五种类型的细胞组成,这些细胞在几个细胞尺寸的维度内形成局部空间连接,这些紧密有序的结构允许细胞间相互作用来维持血糖稳态;骨骼肌是一种典型的各向异性组织,由肌纤维组成的肌束(单细胞精度级别)在神经支配下通过松弛和收缩之间的转换表现出正常的肌肉功能;肺泡具有单细胞特征的气-液界面,为保证气体的交换效率提供了充足的面积(100-140平方米)。这些具有单细胞特征的异质结构对天然组织中的功能至关重要。然而,当使用细胞群作为构建单元时,很难在体外还原这些精细特征。在这些工程化细胞微环境中,细胞自组装的过程进一步增加了精确还原天然微环境异质结构的难度。另一方面,由于同一细胞群内存在异质性,也需要开发具有单细胞分辨率的高通量平台来促进单细胞分析的探索。因此,开发具有单细胞分辨率的生物制造策略对于促进体内和体外组织工程的应用具有重要意义。在本文中,作者对单细胞分辨率生物制造策略的最新进展进行了系统和详细介绍。
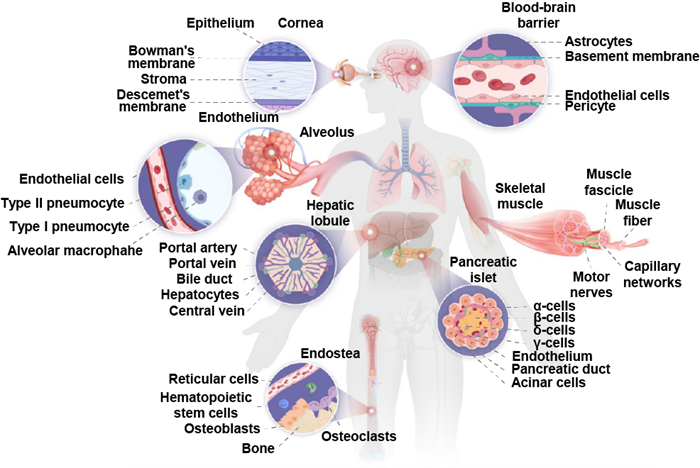
图2 人体内具有单细胞特征的代表性组织/器官。
3.最新进展
单细胞分辨率生物制造是指可以制造具有单个细胞特征的工程化生物学产品的技术。例如,通过单细胞捕获或单细胞打印,可以实现对单细胞分离和沉积的精确可控,构建单细胞模型进行单细胞分析和细胞行为研究。单细胞纤维的组装也可用于肌肉和神经等各向异性组织的精确制造,而单层细胞片的组装可用于多层组织制造。这些单细胞特征的构建块可被视为基本单元,通过有序组装以构建高阶异质结构。因此,根据最小构建单元的维度,我们将具有单细胞分辨率的生物制造策略分为三种类型,即0D(单细胞液滴/微球),1D(单细胞纤维)和2D(单细胞片)。图3展示了基于细胞群和单细胞两种分辨率的构建单元。同维度下,单细胞结构单元的分辨率更好,但通常情况下,细胞群构建单元的稳定性更强。
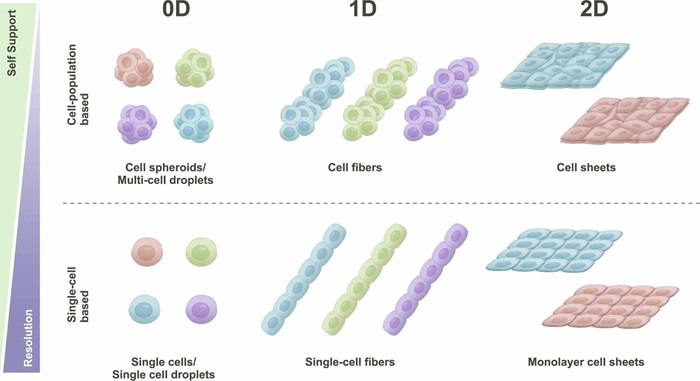
图3 展示对应“点、线、面”三种维度下,基于细胞群和单细胞两种分辨率的构建单元。
单细胞0D构建单元 从细胞群中分离单个细胞是获得0D构建单元的第一步。目前实现单细胞分离常用的技术可以分为界面屏障捕获和无约束捕获两种,其中前者在捕获细胞的同时完成了单细胞的图案化,且无法改变单细胞的位置从而变化图案形状;后者因不受界面屏障的约束,因此可以在捕获细胞后再次改变细胞的位置以实现图案/结构形状的变化。由于高精度和高通量的特点,喷射式打印技术已被应用于实现单细胞液滴的打印。微流控技术的引入可提高细胞液滴的可控性,通过反馈筛选系统实现包含单个或数个细胞的液滴生成。液滴式微流控技术与喷射式打印技术集成进一步提高了基于0D单细胞生物制造的能力。
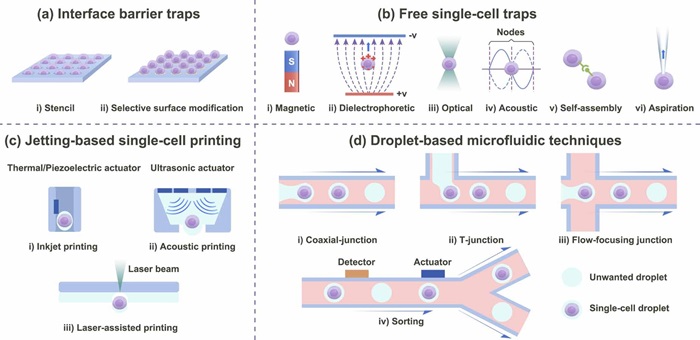
图4 0D构建单元技术:(a)模板法或表面改性法进行细胞选择性捕获;(b)基于不同力类型的细胞捕获/组装技术;(c)基于喷射式的单细胞液滴打印技术;(d)微流控技术生产和分选单细胞液滴。
单细胞1D构建单元 定向性拓扑结构已被证明可以引导细胞伸展,因此精准构建具有单细胞分辨率的细胞纤维结构对各向异性组织工程化制造尤为重要。目前铸模法和挤出法是常用于制造1D构建单元的办法。其中铸模法可通过改变微通道的图案获得相应的结构,但模具的精细结构不利于流动性差的溶液(如高细胞密度或高粘度材料)填充成型,且该方法在制造三维复杂结构上具有挑战性。 挤出法包括挤出式打印技术、静电纺丝/近场直写技术和湿法/微流体技术等。挤出式打印技术需要限制喷嘴的直径来实现单细胞通过以获得单细胞1D构建单元,但生物墨水的粘度提高会降低细胞的活性;静电纺丝/近场直写技术和湿法/微流体技术是通过施加外力来减少细胞纤维的直径,因此对喷嘴的直径限制较小。值得一提的是,按模块组装的策略,1D构建单元也可以通过沿同一方向连续排列组装0D构建单元实现。
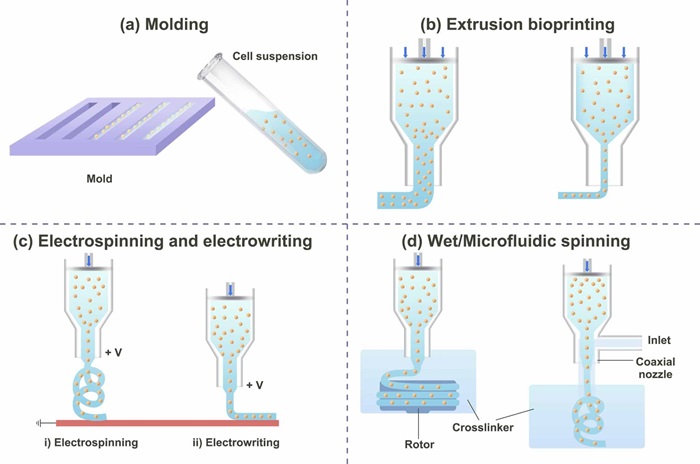
图5 1D构建单元技术:(a)铸模法依赖于具有单细胞特征的预制模具来限制细胞以形成细胞纤维;(b)挤出生物打印通过使用单细胞尺寸特征的微小喷嘴来生成单细胞纤维;(c)静电纺丝/近场直写通过电场拉伸生物墨水以产生单细胞纤维;(d)湿法/微流体纺丝通过引入转子或同轴流以减小细胞纤维的直径。
单细胞2D构建单元 DLP光固化3D打印是通过动态掩膜逐层交联光敏材料实现三维复杂结构制造的技术。目前该技术在Z轴上可以实现5μm分辨率的无细胞打印,但引入细胞后,分辨率约为50μm。生物墨水中的细胞会引起散射降低分辨率,因此未来需要对该技术进行更多地研究如优化光路来生成具有Z方向单细胞特征的3D结构。细胞片技术利于细胞自发形成紧密连接的单细胞层的现象,预先将细胞种植在热敏、光敏等修饰基底表面或将磁化的细胞锚定在磁场中,待单细胞层形成后,通过变化温度、加载光照或去除磁场等手段将单细胞层从基底表面剥离,从而得到单细胞片。该技术为生物制造提供了一种无支架2D构建单元制造策略。得到的单细胞片允许通过叠加、选择和折叠等组装方式形成高阶结构。
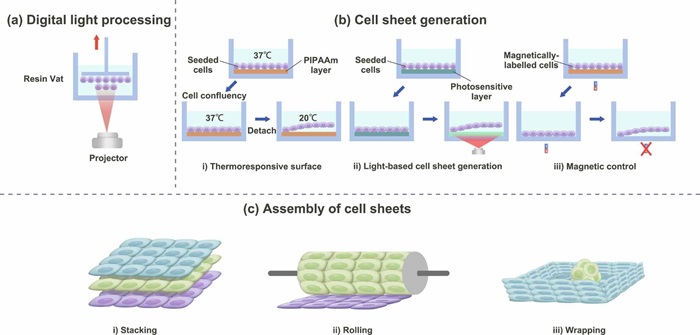
图6 2D构建单元技术:(a)DLP光固化生物打印技术,通过逐层光固化墨水叠加形成结构;(b) 细胞片技术的代表性技术及其细胞汇合和细胞片分离步骤;(c)通过组装工艺制造高阶细胞结构。
4. 未来展望
单细胞分辨率生物制造的应用 具有单细胞分辨率的构建单元组装是一种具有巨大潜力的策略,其可以工程化重建具有单细胞特征的生命系统。尽管早期的单细胞分离、操作技术主要用于细胞高通量筛选和单细胞分析,但最近研究显示了单细胞构建单元空间组装在细胞体外模型和再生医学应用中的优势。如在单细胞分辨率模型和细胞群模型之间发现了细胞行为的差异,这可能与细胞的固有特性和生物物理线索(例如拓扑结构和细胞外基质成分)有关。在再生医学应用中,这些单细胞生物制造技术也可以通过组装用于组织/器官修复的1D和2D单细胞构建单元来制造无支架和高密度细胞结构。不同类型的单细胞可作为0D单细胞构建单元用于直接组装类器官,形成具有成熟功能或大尺寸的高阶类器官,减少干细胞自组装形成类器官的不可预测行为。配合如单细胞分析、筛选和机器学习技术,有望可以选择性组装细胞形成类器官,这可能是提高其可控性,可重复性的替代方法。
跨尺寸构建单元的共组装 力学性能是单细胞生物制造技术的主要挑战。通常,单细胞生物制造获得的生物结构由于结构精细、没有足够的材料支撑,而无法满足植入要求。虽然细胞片已被证明可作为植入物,但这些工程植入物仍难以在体内维持结构。因此,跨尺寸构建单元的共组装是制造符合力学需求的异质结构的替代方案,该组装策略使用细胞群或生物材料构建单元组成力学支撑结构,而单细胞构建单元用于制造具有单细胞特征的精细结构。在模块化组织的生物制造策略中,制造速度与组装单元的尺寸和维度高度相关。因此,考虑分辨率和制造效率之间的平衡,为特定用途选择合适的构建单元对提高制造效率是有帮助的。简而言之,单细胞、细胞群、生物材料的构建单元的共组装策略有望提高大尺寸生命系统的分辨率和制造效率。


 下载:
下载:

