基于多细胞模块组装的器官型血管化组织构建
-
摘要:
综述 ● 开放获取阅读更多
1. 文章导读
构建器官型组织模型在组织发育、疾病进展、药物测试和病原体感染的基础研究及转化研究中发挥着核心作用,而充分的血管化是复杂器官型组织模型成功构建和临床实施的关键决定因素。目前,由于细胞和血管密度低、血管成熟度不足,导致器官型血管化组织构建困难,极大地限制了其在组织工程和再生医学中的应用。为了解决这些局限性,最近的研究采用了预血管化多细胞模块组装来快速生成具有致密血管网络和高细胞密度的功能组织类似物。清华大学机械工程系生物制造中心团队的庞媛副研究员在SCI期刊《极端制造》(International Journal of Extreme Manufacturing, IJEM)上发表《基于多细胞模块组装的器官型血管化组织构建》的综述,系统介绍了基于多细胞模块组装的器官型血管化组织构建技术,其在组织修复与再生、器官级组织生物制造、高级组织建模等方面的应用进展(图1),及该研究领域的挑战和前景。
亮点:
● 总结了用于3D器官型血管化组织构建的多细胞模块组装方法● 解决了通过不同技术构建器官型组织的关键问题● 模块组装具有高细胞密度、高级功能等优势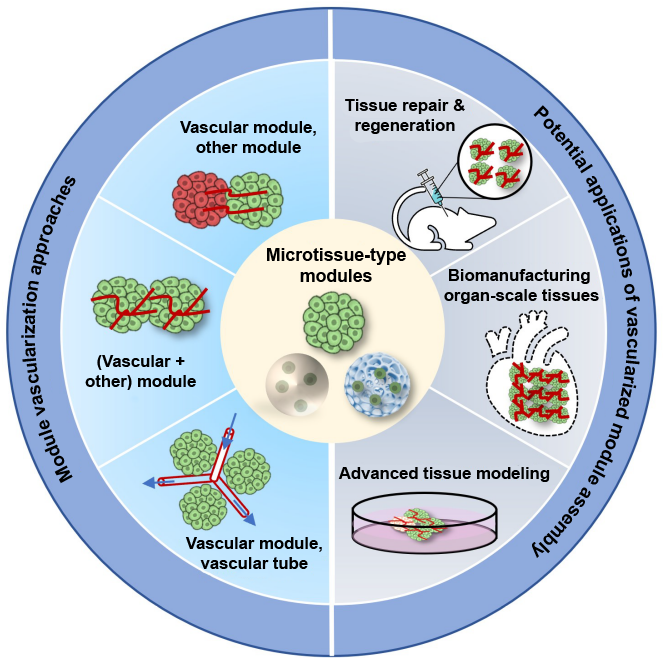
图1 多细胞模块血管化方法和预血管化模块组装的潜在应用。
2. 研究背景
血管系统在物质运输、组织或器官外通讯、疾病进展及药物治疗等过程中发挥着重要作用,因此迫切需要开发一种方法来构建器官型血管化组织,以再现体内的细胞密度和器官级功能。现有的三维血管化组织构建方法都有一个共同特点,即以单个细胞为基本活性模块,在有或没有加入材料的情况下构建三维模型,即"细胞组装"。这些“细胞组装”方法具有细胞密度低、细胞排布无序、无血管系统等问题,阻碍了组织的长期存活和器官级功能的形成。近期,新的模块组装(MoA)方法(即“多细胞微组织模块组装”)被提出用于构建三维器官型血管化组织(图2)。该方法采用含多个细胞的微组织作为基础模块,用于组装成复杂且先进的三维结构体,具有多功能性、灵活性和可扩展性等特点,弥补了目前器官型血管化组织构建技术之间的不足,促进下一阶段组织工程和再生医学的发展。MoA方法构建的器官型血管化组织具有更好的仿生性,在药物评估中具有更高的保真度,可用于多种基础和转化研究。
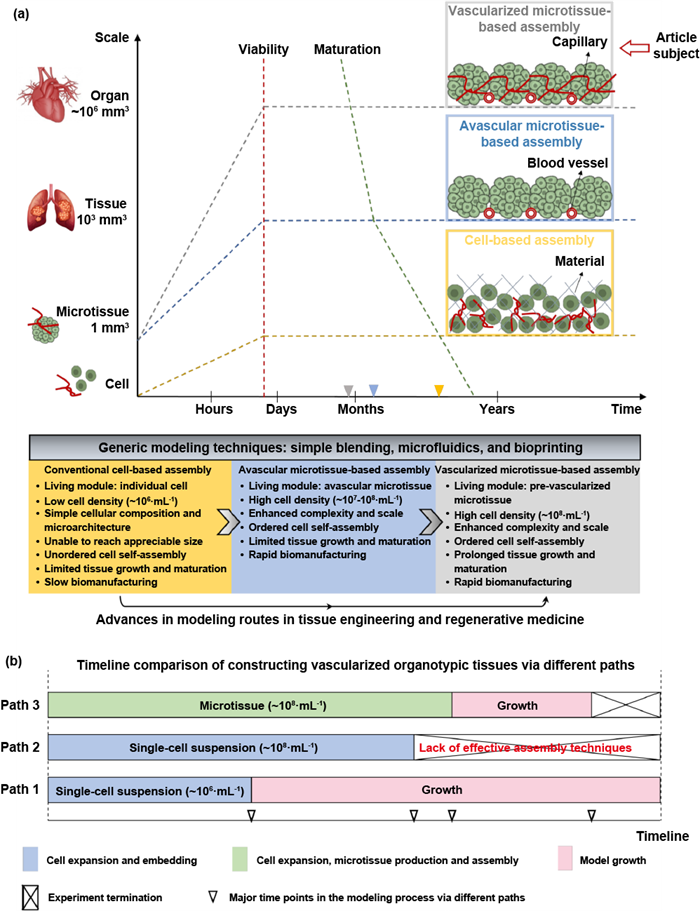
图2 不同建模途径的特点,包括基于细胞和基于微组织的组装。(a) 与基于细胞或无血管微组织的组装方法相比,预血管化MoA可快速生成具有高细胞密度、组织良好的微结构和完整脉管的增尺寸功能组织替代物。(b) 构建血管化器官型组织的可行路径和时间段。
3.最新进展
本综述主要介绍了不同类型微组织模块的制备、MoA技术和模式、模块预血管化策略、及预血管化MoA的应用,包括组织修复和再生、器官级组织构建以及高级组织建模。
3.1 组织模块的制备和组装
组织模块的种类 用于构建器官型结构的模块包括无支架和基于支架的微组织(图3)。无支架微组织可能以细胞团簇(也称为细胞球或类器官)的形式呈现,通常采用特殊的培养设备来制备。基于支架的微组织可能是采用冷冻干燥或微滴乳化制备的载细胞多孔微球,或是通过液滴微流控或生物打印制备的实心微胶。与主要依赖生物材料的传统组织工程方法不同,基于MoA方法构建的主要成分是纯细胞,加入材料主要是用于初始结构支持和细胞团簇快速融合,因此材料的选择标准一般包括生物相容性、可降解性和溶胶-凝胶态可转变性等。
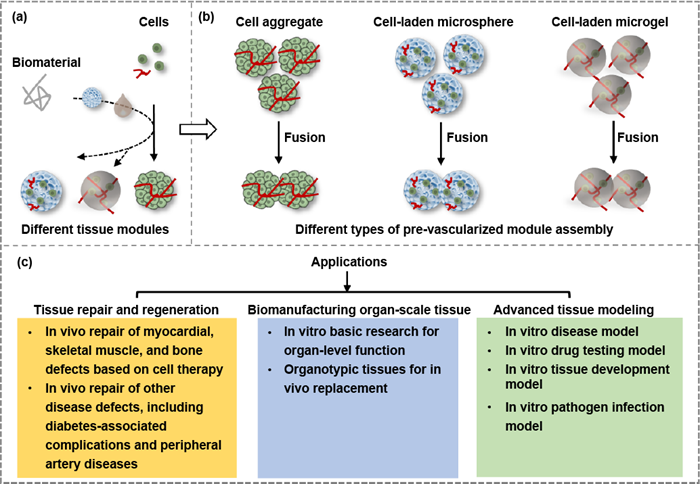
图3 不同类型的预血管化MoA及其应用。(a) 无支架或基于支架的组织模块的制备。(b) 用于组装的组织模块包括细胞团簇、含细胞的微球和含细胞的微凝胶。(c) 预血管化MoA的应用包括组织修复和再生、器官级组织的生物制造以及先进的组织建模。
用于MoA的技术 用于MoA的技术可分为设备辅助、微流控辅助和生物打印辅助(图4)。典型的设备包括微孔板、微室、微管、旋转或振荡生物反应器、悬滴,利用外力或狭小空间迫使组织模块随机接触和融合。微流控系统为操控类器官融合提供了一种灵活和可扩展的方法。生物打印使得在各种尺度上操控模块成为可能,常见策略包括挤出、抽吸、声控和磁控等。

图4 MoA技术。(a) 微板辅助随机模块融合方法。(b) 用于半随机模块融合的液滴辅助方法。(c) 微流体辅助的无序或半有序MoA和可扩展组织制造方法。(d) 用于随机或半随机MoA和大规模组织制造的挤出生物打印辅助方法。(e) 用于定向MoA和大规模组织制造的抽吸式生物打印辅助方法。
不同应用下的MoA模式 根据模块数量,组装可分为二元、三元和多元融合模式(图5)。根据模块类型不同,组装也可分为同型或异型融合模式。目前,通过不同的组装模式,可以发展出不同类型的器官型组织,包括多器官系统、器官级组织和复杂组织模型。多器官系统的构建,可以通过融合不同器官或组织来源的组织模块,在创造相对的物理隔离的同时实现直接的细胞间通讯。多器官系统为肿瘤侵袭机制、组织发育、器官间功能控制等研究提供了有力工具。具有不同大小、形状和形态的组织模块可组装用于复杂、分层和宏观结构的构建。
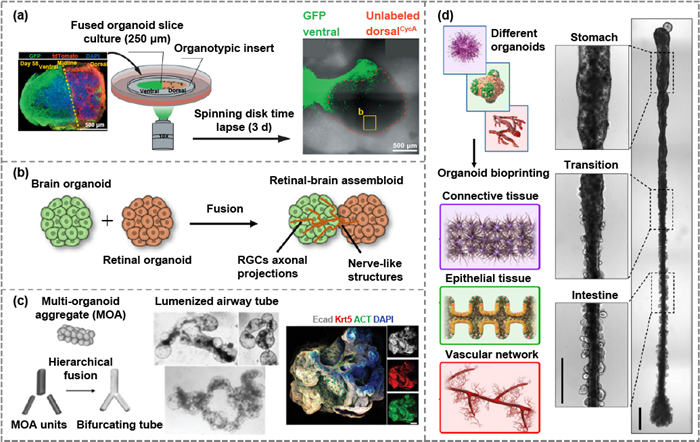
图5 用于各种应用的MoA格式。(a) 通过整合腹侧和背侧类器官生成前脑回路的示意图。(b) 通过生成视网膜-大脑装配体重建视觉通路的策略。(c) 组装 "多类器官团簇"模块以重现分枝管状器官分层设计的示意图。(d) 通过类器官生物打印再现宏观组织自组装的策略。
组织模块的预血管化策略 血管系统作为器官型组织的结构基础,必须能够及时形成,从而参与和促进组织生长发育及器官特异性功能的形成。内皮细胞是血管的关键细胞成分,应被纳入血管化器官型结构。常见的策略是将实质细胞与血管内皮细胞/祖细胞共培养用于制备预血管化模块;另一种策略则是将预先建立的实质模块和内皮模块共培养。
3.2 预血管化MoA用于高级组织工程和再生医学
组织修复与再生 通过功能细胞移植或组织贴片进行细胞治疗手段是治疗非再生疾病相关缺陷的潜在策略。使用预血管化组织模块进行移植可能提高细胞治疗的效果(图6)。在心肌缺损治疗中,预血管化模块可用于改善心肌贴片的治疗效果,也可用于在体外构建血管化组织,为心血管疾病药物筛选提供可靠模型。在骨骼肌组织缺损治疗中,组织模块的塑性变形特性使得注射进入损伤部位成为可能。在骨组织修复中,将治疗细胞添加到预血管化的组织模块中可以实现有效的递送并优化修复效果。此外,MoA策略也被用于治疗其他非再生疾病,如糖尿病并发症和外周动脉疾病。
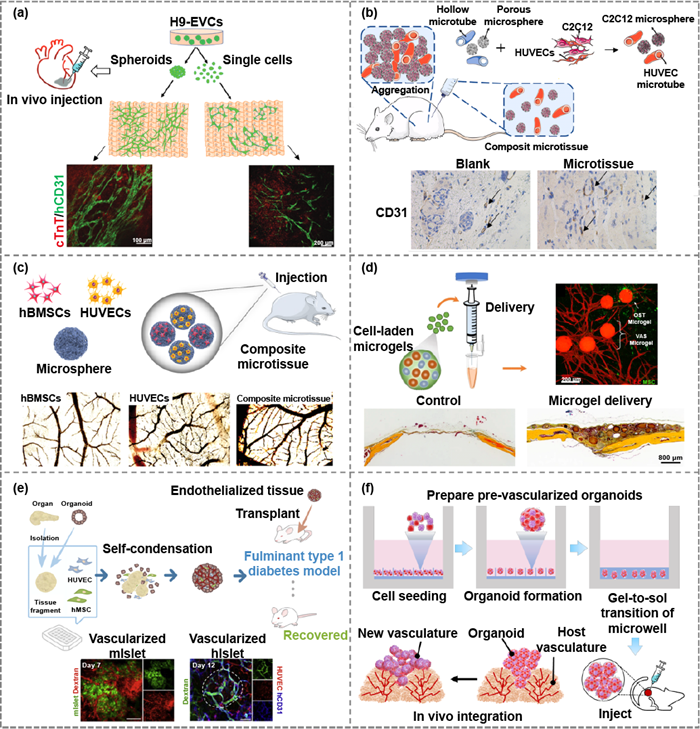
图6 用于组织修复和再生的预血管化MoA。(a) 早期血管细胞(EVC)球改善了3D打印厘米级心脏组织的血管化。(b) 由含有 C2C12 的微球和含有 HUVEC 的微管组成的复合微组织改善了小鼠的成肌性能。(c) 由含 hBMSC 和 HUVEC 的微球组成的混合微组织可增强小鼠的骨样再生能力。(d) 结合成骨和血管生成微凝胶的混合结构体支持临界尺寸缺损的骨再生。(e)通过移植微型血管化胰岛,在体内快速诱导功能性血管网络。
器官级组织构建 通过组织工程构建人造器官具有广阔的应用前景。然而,为治疗目的创建和维持致密的细胞结构(>108个细胞/毫升)是极其困难的。使用预血管化MoA方法可以获得具有所需细胞密度、微观结构和功能的组织(图7)。结合牺牲生物打印和MoA,可快速构建治疗所需的可灌注心脏组织。结合人造软性三维毛细血管网络和类器官MoA,可构建高度复杂的毫米级组织结构。结合全细胞生物墨水打印和数十亿人体细胞的发育,可快速制造器官级组织。

图7 用于生物制造器官级组织的预血管化MoA。(a) 组织模块构成的活基质中通过“牺牲写入功能组织(SWIFT)”打印内皮化分叉通道,构建可灌注全细胞组织。(b) 人多能干细胞(hPSC)球在带有软性微流体毛细管网格的3D打印芯片上培养时融合成实体组织。(c) 团簇型生物墨水的打印和后续分化原理。
高级组织建模 高效再现高度复杂的体内环境和血管介导的细胞-细胞和细胞-环境相互作用仍是3D组织模型构建的一个主要挑战。研究人员正越来越多地使用MoA来制造复杂的血管化器官型组织(图8)。基于MoA的3D肿瘤模型可以模拟肿瘤微环境,也可用于研究抗肿瘤治疗的药代动力学,为个性化治疗提供辅助诊断工具。病毒感染相关的神经营养病理学模型是MoA的另一应用方向。
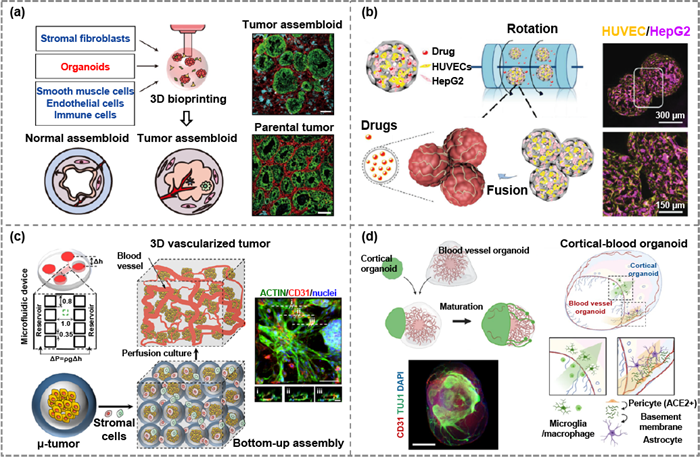
图8 用于高级组织建模的预血管化MoA。(a) 重现人尿道癌病理生理学的组织装配体的生成。(b) 构建基于内皮化团簇的肿瘤模型的原理及其在增尺寸组织制造和药物筛选中的应用。(c) 微型肿瘤和基质细胞(包括内皮细胞)通过微流控设备组装成一个巨大的三维血管化肿瘤模型。(d) 构建血管-皮层装配体的原理,通过该原理我们可以观察血管穿透和神经元萌发。
4. 未来展望
与传统的血管化组织生物制造方法相比,利用多细胞微组织作为基本模块已成为一种新策略,可快速生成细胞密度高、微结构有序、血管完整的功能性组织替代物。通过构建多器官系统、器官级组织以及先进的组织模型,这些特点极大地促进了 MoA在组织工程和再生医学中的应用。此外,其组装的灵活性和可扩展性还可根据形状、大小和细胞类型构建同质或异质组织,从而扩大了应用范围。虽然MoA方法在研究器官级生物活动方面迈出了前所未有的一步,但仍有几个问题有待解决,包括预血管路径标准化、提高血管质量、培养方案的标准化、检测方法和平台的匹配。


 下载:
下载:

